Это верно, что существует ряд нежелательных или попутных металлов (Cu, Sn, Sb, As), которые попадают в поток рециркуляции, например, из кузовов автомобилей, которые измельчаются в металлолом без удаления всей медной проводки или олова. стальные банки Сурьма и мышьяк имеют тенденцию проникать из низкокачественных и недорогих первичных источников железа.
Ответ на вопрос - нет. Переработанная сталь смешивается как можно более равномерно из различных источников, измеряется ее состав, а затем по мере необходимости добавляется чистое железо для разбавления трамвайных металлов до приемлемых уровней для перепродажи или дальнейшей обработки, например, для достижения определенной марки стали для конкретного продукта. или приложение. Нержавеющие стали и другие высоколегированные марки, известные во время переработки, обрабатываются отдельно из-за значения Ni, Cr и т. Д.
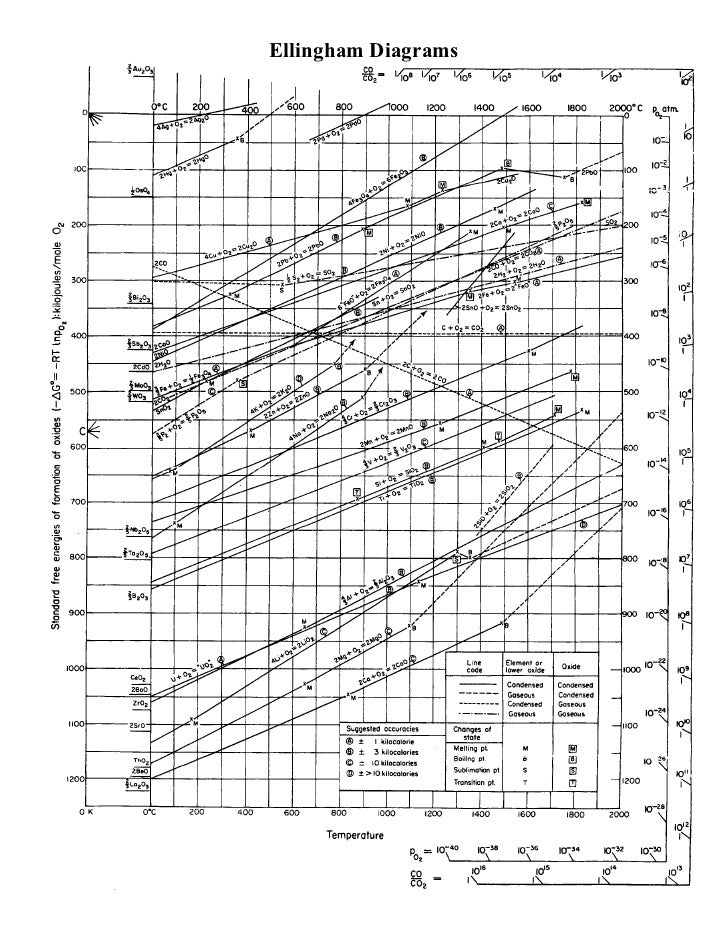
В настоящее время нецелесообразно перерабатывать железо для удаления элементов бродяги, и поэтому это просто не делается вообще. В двух книгах упоминается, что процесс является регулярным и экономичным: ( Полезные ископаемые, металлы и устойчивое развитие: удовлетворение будущих потребностей в материалах , стр. 284, начиная с «разбавления») и ( Производство стали: процессы, продукты и остаткиНачиная с п. 104, читай, пока это уже не актуально). Причина, по которой это неэкономично, состоит в том, что элементы бродяги реагируют с кислородом более слабо, чем железо при постоянной температуре, поэтому для их удаления путем окисления сначала потребуется окислить все железо. Причиной этого является термодинамика, и она основывается на том факте, что среди конкурирующих реакций те, у которых наибольшее уменьшение свободной энергии идет практически до завершения, даже до начала других реакций, особенно с большими различиями в свободной энергии среди конкурирующих реакций. Чтобы определить, какие реакции имеют наибольшее снижение, можно использовать диаграмму Эллингема.
На приведенной ниже диаграмме Эллингема горизонтальная ось - это температура, вертикальная ось - это изменение свободной энергии Гиббса. Линии, проходящие через диаграмму под различными углами, соответствуют изменению свободной энергии, вызванному реакциями окисления элементов кислородом, в зависимости от температуры. В нашем случае диаграмма может быть прочитана путем выбора интересующей температуры и чтения снизу, чтобы найти первый элемент, который вступит в реакцию с кислородом. Например, если у нас есть сталь с Fe, Mn, Sn и Cu в ней, мы можем видеть, что при 1000K Mn, Fe (до FeO), Sn и Cu являются порядком наибольшего или наименьшего падения свободной энергии.
Разумеется, интересующая температура ближе к 1900 К (выше точки плавления железа), но общие тренды каждой функции изменения свободной энергии Гиббса продолжают справа на диаграмме, а железо остается ниже элементов-бродяг Cu, Sn, As и Sb при практических температурах и, вероятно, до их соответствующих температур кипения. В результате удаление бродяг из Fe потребовало бы сначала эффективного окисления всего железа. А поскольку Sn, Sb, As и Cu слабо растворимы в железе, они требуют отделения посредством химической реакции.
Можно увидеть растворимость бродяг по их фазовым диаграммам с железом, о которых я выложил Sb-Fe ниже. Диаграмма имеет зависимость температуры от состава, причем каждая смежная двумерная область состоит из одной фазы или смеси двух фаз слева и справа, которые находятся в равновесии при таком сочетании температуры и состава. Внизу слева мы видим, что для небольших количеств Sb и комнатной температуры существует смежная область, которая в этом случае обозначает одну фазу, или альфа-Fe (вид, с которым мы знакомы). Поскольку присутствует Sb, и он находится в одной фазе, он должен быть растворен в железе. То же самое верно, с различной степенью тяжести, других бродяг.

(источник: himikatus.ru )
Как прокомментировал Крис Х., также возникает вопрос, когда контролируются другие легирующие элементы. Обычно добавление сплава контролируется как можно ближе к затвердеванию, чтобы минимизировать потери сплава.
Лом расплавляется навалом в электродуговой печи. Если поток металлолома достаточно смешан, то концентрация бродяги может быть оценена на основе прошлого использования, и первичное железо добавляется до химического анализа, чтобы компенсировать оценку. Затем основная масса расплавляется, кислород удаляется путем добавления элементов внизу диаграммы Эллингема, в частности, Ca и Al, и расплавленный металл переносится в один или несколько высокоизолированных ковшей. Са и Al быстро реагируют с кислородом, растворенным в расплаве, с образованием оксидного шлака низкой плотности, который плавает и удаляется механически. Химия берется после этого процесса, и если бродяги достаточно разбавлены, металл переносится в ковши. Если нет, то для разбавления расплава добавляют достаточное количество первичного железа.
Попав в ковш, добавляются дополнительные легирующие элементы. Они не добавляются ранее из-за диаграммы Эллингема: большинство легирующих элементов, включая Mn, Mo, Cr, V, C и т. Д., Имеют большую потерю свободной энергии, чем Fe, и поэтому реагируют первыми. Другими словами, они исчезают. Чтобы избежать выцветания при добавлении дорогих сплавов, их добавляют как можно ближе к процессу затвердевания. Кроме того, благодаря удалению кислорода с использованием сначала Al и Ca, в железе растворяется меньше кислорода, чтобы реагировать с более дорогими легирующими элементами. Оказавшись в ковше, очень мало турбулентности границы раздела жидкость-атмосфера, поэтому диффузия нового кислорода в жидкое железо происходит относительно медленно. Конечно, еще есть ограничение по времени, и слишком длительное удерживание ковша приведет к выцветанию сплава. После добавления сплава проверяют химию, а затем разливают ковш.
Отредактировано для добавления источников. Отредактировано, чтобы добавить обсуждение контроля сплава.

